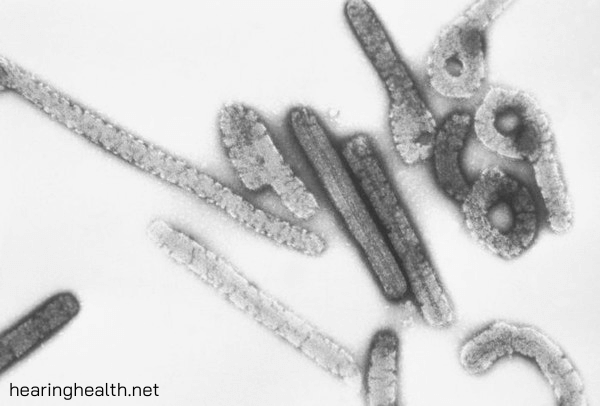โรคไวรัสมาร์บูร์ก (MVD) เดิมชื่อไข้เลือดออกมาร์บูร์ก เป็นโรคที่รุนแรงในมนุษย์ที่เกิดจาก Marburg marburgvirus (MARV) แม้ว่า MVD จะเป็นเรื่องผิดปกติ แต่ MARV ก็มีศักยภาพที่จะทําให้เกิดการแพร่ระบาดโดยมีอัตราการเสียชีวิตอย่างมีนัยสําคัญ การระบาดของ MVD ที่บันทึกไว้ทั้งหมดมีต้นกําเนิดในแอฟริกา MVD ไม่ใช่โรคในอากาศและถือว่าไม่ติดต่อก่อนที่อาการจะปรากฏขึ้น โรคไวรัสมาร์บูร์ก การสัมผัสโดยตรงกับเลือดและของเหลวในร่างกายอื่น ๆ ของผู้ติดเชื้อและสัตว์หรือการสัมผัสทางอ้อมกับพื้นผิวและวัสดุที่ปนเปื้อน เช่น เสื้อผ้าเครื่องนอนและอุปกรณ์ทางการแพทย์เป็นสิ่งจําเป็นสําหรับการส่งผ่าน MARV [1] ดังนั้นหากปฏิบัติตามมาตรการป้องกันและควบคุมการติดเชื้อที่เหมาะสมอย่างเคร่งครัดความเสี่ยงของการติดเชื้อจะถือเป็นเพียงเล็กน้อย ไม่มีวัคซีนที่ได้รับการอนุมัติสําหรับ MVD อย่างไรก็ตาม วัคซีน MVD ของผู้สมัครหลายคนอยู่ในการทดลองทางคลินิก
เชื้อโรค
ไวรัส Marburg เป็นไวรัส RNA ที่เป็นเส้นใยห่อหุ้มเดี่ยวและความรู้สึกเชิงลบซึ่งเป็นของตระกูล Filoviridae สกุล Marburgvirus มี Marburg marburgvirus สายพันธุ์เดียวซึ่งรวมถึงไวรัสสองตัว: ไวรัส Marburg และ Ravn ที่มีความแตกต่างทางพันธุกรรมประมาณ 20% [4] MARV Musoke, แองโกลา, Ci67, Ozolin, Popp, Ratayczak และ Voege เป็นตัวแปร MARV ที่มีความแตกต่างของจีโนมน้อยกว่า [5] ไวรัส Marburg ทั้งสองชนิดก่อให้เกิดโรคที่แยกไม่ออกทางคลินิก (MVD) และเป็นเชื้อโรคร้ายแรงของมนุษย์ซึ่งเชื่อมโยงกับโรคระบาดไข้เลือดออกหลายแห่งในแอฟริกา
จีโนม MARV เข้ารหัสโปรตีนโครงสร้างเจ็ดชนิดที่มีบทบาทแตกต่างกันในการเกิดโรค MVD ไวรัสอาร์เอ็นเอมีความสัมพันธ์กับนิวคลีโอโปรตีน (NP), โปรตีนจากไวรัส 30 (VP30), VP35 และ L-polymerase (L) ซึ่งก่อตัวเป็นนิวคลีโอแคปซิด เมทริกซ์ (ประกอบด้วย VP40), VP24 และซองไขมันที่มีไกลโคโปรตีนจากพื้นผิว (GP) แหลมล้อมรอบไรโบนิวคลีโอโปรตีน
โทรปิซึมของเซลล์และเนื้อเยื่อและฟิวชั่นเมมเบรนเซลล์ไวรัสถูกกําหนดโดย MARV GP นอกจากนี้ GP อาจมีบทบาทในการหลีกเลี่ยงภูมิคุ้มกันโดยการต่อต้านฤทธิ์ต้านไวรัสของ tetherin ซึ่งเป็นโปรตีนกระตุ้นต้านไวรัส interferon (IFN) ที่ยับยั้งการแพร่กระจายของไวรัส VP40 เป็นปัจจัยความรุนแรงที่ต่อต้านการตอบสนองทางภูมิคุ้มกันโดยธรรมชาตินอกเหนือจากการเป็นโปรตีนเมทริกซ์ที่สําคัญ หน้าที่หลักของ VP40
ในวิทยาภูมิคุ้มกันวิทยา MARV คือ การยับยั้งการตอบสนองของเซลล์โฮสต์ต่อการส่งสัญญาณ IFN VP35 เป็นปัจจัยความรุนแรงแบบมัลติฟังก์ชั่นที่อํานวยความสะดวกในการหลีกเลี่ยงภูมิคุ้มกันโดยทําให้การตอบสนองของ IFN ลดลงและมีความสําคัญต่อการสังเคราะห์ RNA ของไวรัส โปรตีนเมทริกซ์รอง VP24 บล็อกการตอบสนองของเซลล์ต่อ IFN [7] โปรตีน L เป็นสื่อกลางในการจําลองแบบจีโนมและการถอดความ
MARV จัดอยู่ในกลุ่มเสี่ยง 4 (RG-4) และต้องมีมาตรการกักกันและการป้องกันสิ่งกีดขวางที่เข้มงวดสําหรับบุคลากรในห้องปฏิบัติการ รวมถึงทุกคนที่ดูแลผู้ป่วยที่อาจติดเชื้อหรือร่างกายที่เสียชีวิต
การระบาดของ MVD ตามธรรมชาติส่วนใหญ่เชื่อมโยงกับการที่มนุษย์เข้าสู่เหมืองและถ้ำที่เต็มไปด้วยค้างคาว ซึ่งบ่งชี้ว่าค้างคาวมีบทบาทสําคัญในการแพร่เชื้อ MARV ในปี 2007 MARV ถูกแยกออกจากค้างคาว R. aegyptiacus ซึ่งเป็นหลักฐานที่ชัดเจนว่าสายพันธุ์นี้เป็นตัวแทนของอ่างเก็บน้ำ MARV ธรรมชาติที่สําคัญ (26) อย่างไรก็ตาม การบํารุงรักษาและการแพร่เชื้อไวรัสภายในประชากรค้างคาวยังไม่ทราบแน่ชัด นอกจากนี้ยังไม่ชัดเจนว่าการส่ง MARV จากอ่างเก็บน้ําค้างคาวไปยังมนุษย์เกิดขึ้นได้อย่างไร
เมื่อบุคคลติดเชื้อการส่งผ่านระหว่างมนุษย์จะเกิดขึ้นผ่านการสัมผัสโดยตรง (ผิวหนังแตกหรือเยื่อเมือก) กับเลือดและของเหลวในร่างกายอื่น ๆ (ปัสสาวะน้ำลายอุจจาระอาเจียนน้ำนมแม่น้ำคร่ำและน้ำอสุจิ) ของผู้ติดเชื้อหรือการสัมผัสทางอ้อมกับพื้นผิวและวัสดุที่ปนเปื้อนเช่นเสื้อผ้าเครื่องนอนและอุปกรณ์ทางการแพทย์ นอกจากนี้การติดเชื้ออาจเกิดขึ้นที่เกี่ยวข้องกับการฝังศพของผู้ติดเชื้อ
การสัมผัสกับสัตว์ที่ตายหรือมีชีวิตที่ติดเชื้อรวมถึงพุ่มไม้ (เช่นลิงลิงชิมแปนซีละมั่งป่าและค้างคาว) อาจเป็นแหล่งที่มาของการติดเชื้อ การบริโภค bushmeat มีความสัมพันธ์กับการระบาดของ EBOV พุ่มไม้บางชนิดเช่นลิงชิมแปนซีและละมั่งป่ามีความอ่อนไหวต่อการจําลองแบบของไวรัสและตายจากการติดเชื้อ พวกมันจึงถือว่าเป็นโฮสต์ระดับกลางมากกว่าสายพันธุ์อ่างเก็บน้ำ
การคงอยู่ของลูกอัณฑะ Filovirus เป็นกลไกการส่งผ่านแบบ putative ทําให้เกิดความกังวลเพิ่มขึ้น การศึกษาทดลองแสดงให้เห็นว่าลิงตัวผู้พัฒนาการติดเชื้อ MARV อย่างต่อเนื่องของท่อ seminiferous ซึ่งเป็นบริเวณที่ได้รับสิทธิพิเศษทางภูมิคุ้มกัน กรณีแรกที่มีรายงานการแพร่เชื้อทางเพศที่อาจเกิดขึ้นเกิดขึ้นในช่วงการระบาดของโรค MARV ในปี 1967 ภรรยาของผู้ป่วยชายป่วยสองเดือนหลังจากที่สามีของเธอหายจากโรคนี้ซึ่งได้รับการยืนยันโดยการตรวจหาแอนติเจน MARV ในน้ําอสุจิของสามี
ในเวลาเดียวกันมีการวิเคราะห์น้ำเชื้อของสารพักฟื้นอีกเก้าชนิดเพื่อดูว่ามี MARV หรือไม่ แต่ไม่พบไวรัสหรือแอนติเจนของไวรัส แม้ว่าไวรัสจะถูกตรวจพบในน้ําอสุจิของผู้ป่วยบางรายที่หายจาก MVD นานถึง 203 วันหลังจากเริ่มมีอาการของโรค แต่ก็ไม่มีหลักฐานที่ชัดเจนสําหรับการแพร่เชื้อ MARV
จนถึงปัจจุบันมีรายงาน MVD เพียงไม่กี่กรณีในการตั้งครรภ์ การติดเชื้อ Filovirus โดยทั่วไปจะรุนแรงกว่าในหญิงตั้งครรภ์มากกว่าในสตรีที่ไม่ได้ตั้งครรภ์อาจเป็นเพราะการทํางานของภูมิคุ้มกันที่เปลี่ยนแปลงหรือการมีส่วนร่วมของรก พบไทเทรสของไวรัสสูงในเนื้อเยื่อรกซึ่งบ่งชี้ว่าการแพร่กระจายของไวรัสทางโลหิตจางผ่านรกเป็นเส้นทางที่แพร่หลายที่สุดของการติดเชื้อในครรภ์ตามรายงานกรณี
แม้จะมีอัตราการเสียชีวิตสูงในการตั้งครรภ์ แต่ก็ไม่มีหลักฐานว่าหญิงตั้งครรภ์มีความอ่อนไหวต่อการติดเชื้อ filovirus มากกว่าคนอื่น ๆ สตรีมีครรภ์ที่มี MVD มีแนวโน้มที่จะทําแท้งโดยธรรมชาติหรือการตายคลอด มีข้อมูลน้อยมากเกี่ยวกับผลลัพธ์ของทารกแรกเกิดหลังจากการติดเชื้อ MVD มีรายงาน MVD หลายกลุ่มในทารก และทารกเหล่านี้บางคนมีอาการไม่รุนแรงอย่างน่าประหลาดใจ
การปรากฏตัวของ MARV ในเลือดและอวัยวะและเนื้อเยื่อของบุคคลที่ติดเชื้อหรือฟื้นตัวบ่งชี้ว่าการแพร่เชื้อผ่านการถ่ายและการปลูกถ่ายเป็นไปได้ อย่างไรก็ตามยังไม่มีรายงานการส่ง MARV ผ่านสารที่มาจากมนุษย์
Filoviruses สามารถอยู่รอดได้ในของเหลวหรือวัสดุแห้งเป็นเวลาหลายวัน พวกมันถูกปิดการใช้งานโดยการฉายรังสีแกมมาให้ความร้อนประมาณ 60-75 นาทีที่ 60 ° C หรือเดือดเป็นเวลาห้านาทีและมีความไวต่อตัวทําละลายไขมันโซเดียมไฮโปคลอไรต์และสารฆ่าเชื้ออื่น ๆ
แนะนำ : โรคหลอดเลือดสมองตีบ เกิดขึ้นได้อย่างไร
บทความโดย : สมัคร gclub